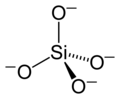
ケイ酸
テンプレート:Chembox ケイ酸(ケイさん、珪酸、silicic acid)とは、化学式 [SiOx(OH)4−2x]n (例:ケイ酸ナトリウムはNa2SiO3)で表されるケイ素、酸素、水素の化合物の総称である。確認されているものとしては、オルトケイ酸 (H4SiO4)、メタケイ酸 (テンプレート:Chem)、メタ二ケイ酸 テンプレート:Chem などがある。単にケイ酸と呼ぶ場合、メタケイ酸のことを示すことが多い。
例
ケイ酸は二酸化ケイ素(SiO2)に水(H2O)を加えたものであり、理論上はN個以上のケイ素について環状のものやシート状のものなど際限なく考えることが可能。[1]
| オルトケイ酸 orthosilicic acid monosilicic acid |
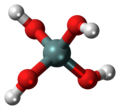
| |
| ピロケイ酸 pyrosilicic acid disilicic acid |

|
| メタケイ酸 metasilicilic acid |

| |
| メタ二ケイ酸 disilicic acid |

|
化学的性質
普通、オルトケイ酸などは単独で存在することは少なく、混合体となっていることが多い。
オルトケイ酸の単離は2017年に産業技術総合研究所のグループにより初めて報告された[2][3]。加水分解を避けるため、テトラベンジルオキシシランをアミド溶媒中においてパラジウム炭素により水素化分解することで、オルトケイ酸を96%の収率で合成できた。そして単離したオルトケイ酸は、テトラブチルアンモニウム塩共存下においてSi(OH)4の正四面体構造として存在することが示されている。
また、メタケイ酸は単純なテンプレート:Chem分子ではなくSiO4四面体が鎖状または環状となった構造である。産業技術総合研究所のグループは、二量体、環状三量体、環状四量体の合成にも成功している。
ケイ酸ナトリウムなどのケイ酸アルカリの濃溶液に酸を加えると、白色無定形の膠状物体ができる。これをふつうケイ酸と呼び、二酸化ケイ素と水とが結合したものであるが、その水の割合は一定していない。
このケイ酸が凝固したものを乾燥空気中で放置し、さらに加熱乾燥させると順次水を失い、500 ℃ で二酸化ケイ素のキセロゲルとなる(シリカゲル)。この間、二酸化ケイ素 1モルに対して一定量の水が化合したと思われるものは存在しないから、このゲル状のケイ酸を一定の化学式で表すことは困難であるが、これらの塩から考えて、オルトケイ酸・メタケイ酸が存在すると考えられている。
ケイ酸は熱水、アルカリに溶け、また、冷水にはわずかに溶けるが、酸には溶けない。濃硫酸、無水エタノールにより脱水される。フッ化水素の作用でただちに分解されヘキサフルオロケイ酸テンプレート:Chemを生成する。水溶液はメチレンブルーによって青黒色となる。
なお、岩石学などでは岩石の組成を酸化物の比率で表記することが一般的であり、二酸化ケイ素をケイ酸ということもある。この二酸化ケイ素の含有量の多いのものは一般的に有色鉱物が少なく「酸性岩」と呼ばれ、花崗岩が典型的な例である。二酸化ケイ素が少なく有色鉱物の多いものは「塩基性岩」と呼ばれ、玄武岩が代表的。さらに二酸化ケイ素含有量が少なく酸化マグネシウムの含有量の多いものは「超塩基性岩」と呼ばれる。
水溶液中の電離平衡
オルトケイ酸は化学式の上からは4価の酸と考えられるが、確からしい酸解離定数が測定されているのは1段目のみで、2段目以降は極めて弱く、正確な測定は困難である。塩基性溶液中ではラマンスペクトルによればテンプレート:Chemのような化学種を含んでいることが示されているが、pHおよび濃度によっては重合したポリケイ酸イオンも存在する[4]。
- ,
,
ケイ酸イオン
最も簡単な構造のものはオルトケイ酸イオン(—さん—、orthosilicate, テンプレート:Chem)であり、形式的にはオルトケイ酸の四段目解離により生成するが、水溶液中ではたとえ強塩基性であってもこのようなイオンは確認されず、マグネシウム塩すなわち橄欖石のような天然鉱物中に存在し、ネソケイ酸塩と呼ばれる。正四面体型構造で、鉄橄欖石結晶中においてSi−O結合距離は164pmである。
縮合して2個のテンプレート:Chem四面体を酸素で架橋した二ケイ酸イオン(テンプレート:Chem)を含む鉱物はソロケイ酸塩と呼ばれ緑簾石などがある。

さらにテンプレート:Chem四面体が鎖状に結合したイノケイ酸塩(テンプレート:Chem, テンプレート:Chem)、環状構造のサイクロケイ酸塩テンプレート:Chem、層状構造のフィロケイ酸塩(テンプレート:Chem)および三次元構造のテクトケイ酸塩(テンプレート:Chem)が存在する。
ケイ酸塩
テンプレート:Main ケイ酸塩(—さんえん、silicate)はケイ酸イオンを含むイオン結晶であり、多くの鉱物の成分となるものである。
二酸化ケイ素と炭酸ナトリウムまたは水酸化ナトリウムを高温で融解するとケイ酸ナトリウムが得られるが、これはオルトケイ酸ナトリウム(Na4SiO4)その他のケイ酸塩の混合物であり、ケイ酸ナトリウムの濃厚水溶液をオートクレーブ中で加熱処理すると水飴状の粘度の高い液体が得られ、水ガラス(みず—)と呼ばれる。
海洋での生成

海洋では、その表層近くで二酸化ケイ素から水和プロセスによってケイ酸が生成し
北極・南極での沈み込みによって深海へ輸送される。人間活動による擾乱を受けることもあるが、表層のケイ酸濃度の上昇は、ケイ酸が自発的に二酸化ケイ素と水に分解することで抑制されている。ケイ酸は主にオルトケイ酸 (H4SiO4) の形で存在し、その生物地球化学的循環は珪藻によって制御されている[6][7]。珪藻はケイ酸を重合させてテンプレート:仮リンクとし、その細胞壁(テンプレート:仮リンク)の素材とする。
生理作用
アルミニウムとアルツハイマー型認知症の関連については長年調査が続けられているが、その一環として、消化管からのアルミニウム吸収を抑制し、腎排泄を促進するためにケイ酸入り飲料を用いることが検討されている[8][9][10]。
また、in vitroでのヒト骨芽細胞様細胞を用いた研究で、オルトケイ酸の細胞内への蓄積は、I型コラーゲンの合成と骨芽細胞への分化を促進することが示された[11]。
栄養補助食品として、コリン安定化オルトケイ酸が利用できる。この物質には、皮膚・爪・毛髪の脆化を防ぎ、機械的強度を維持する作用がある[12][13][14]。また、高齢の卵巣摘出ラットを用いた実験では、大腿骨の骨減少を一部抑制することが示され[15]、仔牛に対して用いた場合でもコラーゲン量の上昇が観察された[16]。骨減少症のヒト女性においても、骨のコラーゲン形成によい影響を与える可能性がある[17]。
参考文献
関連項目
- ↑ テンプレート:Cite book
- ↑ Igarashi, M., Matsumoto, T., Yagihashi, F., Yamashita, H., Ohhara, T., Hanashima, T., Nakao, A., Moyoshi, T., Sato K., Shimada, S., Non-aqueous selective synthesis of orthosilicic acid and its oligomers. Nat. Commun. 8, 140, 1-8
- ↑ 200年にわたる謎に終止符、ガラスの基本単位の構造を決定-オルトケイ酸を用いた高機能・高性能ケイ素材料の創出に期待-、日本原子力研究開発機構、2017年7月27日、2019年3月21日閲覧
- ↑ FA コットン, G. ウィルキンソン著, 中原 勝儼訳 『コットン・ウィルキンソン無機化学』 培風館、1987年,原書:F. ALBERT COTTON and GEOFFREY WILKINSON, Cotton and Wilkinson ADVANCED INORGANIC CHEMISTRY A COMPREHENSIVE TEXT Fourth Edition, INTERSCIENCE, 1980.
- ↑ http://www.nodc.noaa.gov/OC5/WOA09/pr_woa09.html
- ↑ Siever, R. (1991). Silica in the oceans: biological-geological interplay. In: Schneider, S. H., Boston, P. H. (eds.), Scientists On Gaia, The MIT Press, Cambridge MA, USA, pp. 287-295.
- ↑ Treguer, P., Nelson, D. M., Van Bennekom, A. J., DeMaster, D. J., Leynaert, A. and Queguiner, B. (1995). The silica balance in the world ocean: A reestimate. Science 268, 375-379.
- ↑ テンプレート:Cite journal
- ↑ テンプレート:Cite journal
- ↑ テンプレート:Cite journal
- ↑ テンプレート:Cite journal
- ↑ テンプレート:Cite journal
- ↑ テンプレート:Cite journal
- ↑ テンプレート:Cite journal
- ↑ テンプレート:Cite journal
- ↑ テンプレート:Cite journal
- ↑ テンプレート:Cite journal